| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| 1g |
|
||
| Other Sizes |
|
| 靶点 |
ACCA/acetyl-CoA carboxylase-α; PPARalpha; apoptosis
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
TOFA(5-十四烷氧基-2-糠酸)对 NCI-H460 肺癌细胞以及 HCT-8 和 HCT-15 结肠癌细胞具有细胞毒性,IC50 值约为 5.0、5.0 和 4.5 μg/mL。那个订单。 1.0–20.0 μg/mL 的 TOFA 以剂量依赖性方式有效抑制脂肪酸的合成并导致细胞死亡 [1]。 TOFA 的 IC50 值分别为 26.1 和 11.6 μg/mL,表明它对 COC1 和 COC1/DDP 细胞具有细胞毒性。 TOFA使细胞周期停止在G0/G1期,引发细胞凋亡,并以时间和剂量依赖性方式抑制癌细胞的生长[2]。乙酰辅酶A-羧化酶-α(ACCA)是控制脂肪酸产生的必需酶。在大多数 PCa 细胞系中,TOFA 诱导的 ACCA 抑制会导致脂肪酸产生减少、半胱天冬酶激活和细胞死亡 [3]。
TOFA(5-四环氧基-2-呋喃酸)是ACCA的一种变构抑制剂,对肺癌细胞NCI-H460和结肠癌细胞HCT-8和HCT-15具有细胞毒性,其IC(50)分别约为5.0、5.0和4.5微克/毫升。1.0 ~ 20.0 μ g/ml的TOFA能有效阻断脂肪酸合成,诱导细胞死亡,并呈剂量依赖性。PARP断裂、DNA断裂、膜联蛋白- v染色均为细胞凋亡的特征。同时补充脂肪酸合成途径的终产物棕榈酸(100微米),可防止TOFA诱导的细胞凋亡。综上所述,这些数据表明TOFA对肺癌和结肠癌细胞是一种有效的细胞毒剂,通过干扰它们的脂肪酸合成来诱导细胞凋亡。[1] 本研究旨在探讨ACC变构抑制剂5 -十四环氧基- 2 -呋喃酸(TOFA)对卵巢癌细胞系COC1和COC1/DDP增殖和细胞周期进展的影响。结果表明,TOFA对COC1和COC1/DDP细胞有50%的抑制浓度(IC50),分别为~26.1和11.6µg/ml。TOFA以时间和剂量依赖的方式抑制癌细胞的增殖,使细胞停留在G0/G1细胞周期,并诱导细胞凋亡。western blot检测细胞周期调节蛋白cyclin D1和cyclin依赖性激酶(CDK) 4的表达,以及凋亡相关蛋白caspase - 3和Bcl - 2的表达。TOFA抑制Cyclin D1、CDK4和Bcl‑2蛋白的表达,而caspase‑3被切割和激活。[2] 在大多数PCa细胞系中,TOFA(5-十四环氧-2-呋喃酸)抑制ACCA可减少脂肪酸合成,诱导caspase激活和细胞死亡。我们的数据表明,TOFA可以通过线粒体途径杀死细胞,因为我们在雄激素敏感细胞系中发现TOFA处理后细胞色素c释放。结果还表明,TOFA的促凋亡作用可能通过降低神经匹林-1(NRP1)和mcl -1的表达介导。我们之前报道过Mcl-1受AR调控,在前列腺癌细胞耐药诱导凋亡中起重要作用,并且已知NRP1调控Mcl-1的表达。[3] |
||
| 体内研究 (In Vivo) |
TOFA对小鼠卵巢癌异种移植物生长的抑制作用[2]
为了研究TOFA是否在体内抑制肿瘤生长,我们使用人卵巢癌小鼠异种移植模型研究了TOFA的作用。将COC1/DDP细胞注射到雌性裸鼠体内,测定TOFA处理后的肿瘤大小。与dmso处理的对照组小鼠相比,TOFA显著抑制肿瘤生长速度(1649±356.3比5128±390.4 mm3;图4)。为了检测TOFA的毒性,我们用H&E染色法检测了TOFA对小鼠多个器官的影响(图4B)。在心脏、肝脏、脾脏、肺、肾和肠组织中未观察到毒性(数据未显示)。[2] TOFA 抑制小鼠卵巢肿瘤异种移植物中 COC1/DDP 细胞的生长。与用 DMSO 处理的对照小鼠相比,TOFA 显着抑制肿瘤生长速率(1649±356.3 对比 5128±390.4 mm)3。肺、肾、脾、心和肠组织没有表现出任何毒性。 TOFA可能会发展成为一种有前途的小分子药物,通过阻断ACC来治疗卵巢癌[2]。 |
||
| 酶活实验 |
细胞凋亡[1]< br >
细胞凋亡通过PARP切割、DNA断裂、膜联蛋白- v染色和FACScan分析进行评估。如上所述,采用Western blot检测PARP裂解;如前所述,检查DNA片段;如前所述进行annexin-V染色和FACScan。
脂肪酸合成[1] 细胞在12孔板上每孔用1 μCi 2- 14c标记的乙酸(53 mCi/mmol)在37℃,5% CO2下脉冲4小时,然后进行脂质合成分析,如前所述。 |
||
| 细胞实验 |
细胞增殖试验[2]
将TOFA溶解在二甲基亚砜(DMSO)中,制成50 mg/ml的原液。细胞(1×104 cells/孔)接种于96孔板,用不同浓度(0、1、5、10、20、50 μg/ml)的TOFA孵育。使用从Dojindo购买的细胞计数试剂盒-8 (CCK-8),根据制造商的说明,通过测量四氮唑盐WST-8对甲醛的还原,评估TOFA处理后24、48和72 h的细胞增殖。在每个时间点,每孔中加入10 μl CCK-8溶液,37℃培养2 h,收集每板上清,在450 nm处测定吸光度。细胞增殖抑制率和50%抑制浓度(IC50;抑制率(%)= [(Ac−Ae)/(Ac−Ab)] × 100%,其中Ae为实验孔中培养基的吸光度;Ac为对照孔中培养基的吸光度,Ab为空白孔中培养基的吸光度。 细胞周期分析[2] 将COC1和COC1/DDP细胞以2×105细胞/孔的密度接种于6孔板中,分别加或不加TOFA(5或10 μg/ml)处理24、48和72 h。细胞周期分析,466 × g离心5 min,并用冷磷酸盐缓冲盐水(PBS)洗涤2次。细胞用70%的冰镇乙醇固定,保存于- 20℃。24 h后用PBS洗涤细胞,用RNase A处理,并根据制造商的方案在37°C下孵育30分钟。加入碘化丙啶(PI) 400 μl (20 μg/ml溶液),黑暗孵育30 min,在488nm处测定吸光度。 细胞凋亡分析[2] 分别用TOFA(0、1、5、10、20、50 μg/ml)处理卵巢癌细胞COC1和COC1/DDP (2×105 cells/well) 24、48、72 h,按说明书使用凋亡检测试剂盒。收集细胞,466 × g离心5 min,冷PBS洗涤2次,悬浮于100 μl结合缓冲液中。在细胞培养液中加入Annexin V-FITC (5 μl)和PI (5 μl),室温暗室培养15 min。加入400 μl的结合缓冲液,流式细胞术检测488nm 的荧光强度。 TOFA抑制卵巢癌细胞增殖[2] 为研究TOFA对卵巢癌细胞的影响,采用不同浓度TOFA (1 ~ 50 μg/ml)处理COC1和COC1/DDP细胞株24 ~ 72 h,观察细胞增殖情况。发现不同浓度的TOFA以浓度和时间依赖的方式抑制COC1和COC1/DDP细胞的生长(图1)。TOFA还被证明对卵巢癌细胞具有高度的细胞毒性。处理48 h后,COC1和COC1/DDP细胞对TOFA的IC50值分别为~26.1和~11.2 μg/ml。这些数据表明脂肪酸合成在卵巢癌细胞系COC1和COC1/DDP的增殖中起重要作用。 TOFA诱导细胞周期阻滞[2] 为了研究TOFA是否诱导卵巢癌细胞周期阻滞,我们将COC1和COC1/DDP细胞与TOFA一起培养24、48和72 h,然后用FACScan分析细胞计数。TOFA处理的COC1细胞停留在G0/G1期。特别是,5 μg/ml TOFA处理48和72 h, COC1细胞处于该期的比例分别为50.2%和51.1%,而未处理的对照组分别为28.1%和34.4% (P<0.01)(图2B和C)。10 μg/ml TOFA处理72 h, COC1/DDP细胞处于G0/G1期的比例从38.3%(对照组)增加到43.0% (P<0.05);图2 g)。这些结果表明,细胞周期从G1期到S期的进展与脂肪酸合成有关。为了研究细胞周期阻滞的机制,使用western blot分析检测了周期蛋白D1和周期蛋白依赖性激酶(CDK) 4的蛋白水平,这两种蛋白调节从G1期到S期的进展(图2D和H)。COC1和COC1/DDP细胞的TOFA处理以剂量依赖的方式降低了周期蛋白D1蛋白水平。然而,在TOFA处理的COC1细胞(1-20 μg/ml)中,CDK4蛋白水平升高,随后当使用50 μg/ml TOFA时,CDK4蛋白水平下降(图2D)。 将 NCI-H460、人肺癌细胞以及 HCT-8 和 HCT-15 细胞(5,000 个/孔)接种在 96 孔板中过夜,然后暴露于指定浓度(0、1、5、10、20、 50 µg/mL)72 小时。使用MTT测定法检测活细胞。 |
||
| 动物实验 |
|
||
| 参考文献 |
|
||
| 其他信息 |
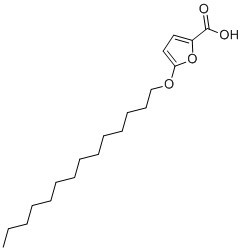
5-(tetradecyloxy)-2-furoic acid is a member of the class of furans that is 2-furoic acid in which the hydrogen at position 5 is replaced by a tetradecyloxy group. It has a role as an EC 6.4.1.2 (acetyl-CoA carboxylase) inhibitor, a PPARalpha agonist, an antineoplastic agent and an apoptosis inducer. It is a furoic acid and an aromatic ether. It is functionally related to a 2-furoic acid.
|
| 分子式 |
C19H32O4
|
|
|---|---|---|
| 分子量 |
324.45
|
|
| 精确质量 |
324.23
|
|
| 元素分析 |
C, 70.33; H, 9.94; O, 19.72
|
|
| CAS号 |
54857-86-2
|
|
| 相关CAS号 |
|
|
| PubChem CID |
115175
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| 密度 |
1.0±0.1 g/cm3
|
|
| 沸点 |
441.7±25.0 °C at 760 mmHg
|
|
| 熔点 |
112-115ºC
|
|
| 闪点 |
220.9±23.2 °C
|
|
| 蒸汽压 |
0.0±1.1 mmHg at 25°C
|
|
| 折射率 |
1.483
|
|
| LogP |
7.82
|
|
| tPSA |
59.67
|
|
| 氢键供体(HBD)数目 |
1
|
|
| 氢键受体(HBA)数目 |
4
|
|
| 可旋转键数目(RBC) |
15
|
|
| 重原子数目 |
23
|
|
| 分子复杂度/Complexity |
293
|
|
| 定义原子立体中心数目 |
0
|
|
| InChi Key |
CZRCFAOMWRAFIC-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C19H32O4/c1-2-3-4-5-6-7-8-9-10-11-12-13-16-22-18-15-14-17(23-18)19(20)21/h14-15H,2-13,16H2,1H3,(H,20,21)
|
|
| 化学名 |
5-tetradecoxyfuran-2-carboxylic acid
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: ~4 mg/mL ( 12.32 mM)
Water: Insoluble Ethanol: Insoluble |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 1 mg/mL (3.08 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 10.0 mg/mL 澄清 DMSO 储备液加入到 900 μL 玉米油中并混合均匀。 配方 2 中的溶解度: 5%DMSO+ 40%PEG300+ 5%Tween 80+ 50%ddH2O : 3mg/ml (9.25mM) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.0821 mL | 15.4107 mL | 30.8214 mL | |
| 5 mM | 0.6164 mL | 3.0821 mL | 6.1643 mL | |
| 10 mM | 0.3082 mL | 1.5411 mL | 3.0821 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
Cytotoxicity of TOFA.Biochem Biophys Res Commun.2009 Jul 31;385(3):302-6. |
|---|
 Apoptosis induced by TOFA.Biochem Biophys Res Commun.2009 Jul 31;385(3):302-6. |
 Inhibition of fatty acid synthesis by TOFA. Palmitate rescues of apoptosis induced by TOFA.Biochem Biophys Res Commun.2009 Jul 31;385(3):302-6. |