| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 50mg |
|
||
| 100mg |
|
||
| Other Sizes |
|
| 靶点 |
α2-adrenoceptor
|
|---|---|
| 体外研究 (In Vitro) |
[3H]Rauwolscine 可逆、立体特异性且饱和地与 α2-肾上腺素能受体结合。在脑膜中,tauwolscine [3H] 选择性识别 α2-肾上腺素受体的高亲和力和低亲和力状态 [1]。根据先前的功能研究,证明育亨宾和萝芙素在 5-HT 自身受体水平上具有激动作用,[3H]萝芙素也可作为 5-HT1A 受体激动剂发挥作用 [2]。当使用 [3H]5-HT 作为放射性配体时,Raufulin 被发现对人类受体具有相当高的亲和力(Ki 人类 = 14.3nM,Ki 大鼠 = 35.8nM)[3]。根据饱和实验,[3H]Rauwolscine 在小鼠、大鼠、兔子和狗中的亲和力相当 (2.33-3.03 nM),但在人类中的亲和力明显更高 (0.98 nM) [4]。
|
| 体内研究 (In Vivo) |
在小鼠、大鼠、兔、狗和人类肾脏的膜制剂中,对α2-肾上腺素受体拮抗剂[3H]-劳沃叶皂苷的结合进行了表征。在所有物种中,结合在45分钟内达到平衡,并在加入酚妥拉明10微M后以单指数率解离。饱和研究表明,[3H]-劳沃叶皂苷的亲和力在所有物种中都是相似的(2.33-3.03 nM),但人类的亲和力明显更高(0.98 nM)。结合位点的密度存在显著差异,按顺序增加:人少于狗少于兔少于大鼠少于小鼠。在所有情况下,Hill系数与unity没有显著差异。[3H]-rauwolscine以低亲和力(KD大于15nM)与豚鼠肾脏制备的膜结合。低亲和力结合不是由于培养基中没有特定离子,也不是由于内源性激动剂占据受体。所有物种的结合都被发现对去甲肾上腺素的异构体具有立体选择性。然而,在异构体之间和物种之间,激动剂与结合位点的相互作用特征存在差异。对于[3H]-劳沃叶皂苷标记的α2-肾上腺素受体,观察到特定α肾上腺素受体拮抗剂的亲和力存在显著差异。这些差异在α1-肾上腺素受体选择性拮抗剂哌唑嗪中最为明显,哌唑嗪在大鼠、小鼠、狗、人和兔中的抑制常数(Ki值)分别为33.2、39.5、261、570和595 nM。[3H]-rauwolscine标记的α2-肾上腺素受体在物种之间的特征存在明显差异,有人认为,对α1-选择性拮抗剂如哌唑嗪观察到的差异可能与α2-肾上腺素能受体附近的其他位点的结合有关[4]。
|
| 酶活实验 |
[3H]Rauwolscine是一种特异且强效的α2-拮抗剂放射性配体,用于表征牛大脑皮层中的α2-受体结合。[3H]Rauwolscine结合是可逆的、立体特异的和可饱和的。关联、解离和饱和研究揭示了一个位点的相互作用(k-1/k+1=1.2 nM,KD=2.5 nM,Bmax=160 fmol/mg蛋白质),竞争研究表明[3H]劳沃叶皂苷标记了α2受体。激动剂以一种浅层、GTP敏感的方式抑制[3H]劳沃司汀结合。这些结果表明,[3H]rauwolscine特异性标记了脑膜中α2受体的高亲和力和低亲和力状态[1]。
在之前的报告中,[3H]5-HT已被用于表征大鼠和人类5-HT2B受体的药理学。5-HT是5-HT2B受体的天然激动剂,作为放射性配体的有用性有限,因为很难使用激动剂放射性配体研究G蛋白偶联受体的激动剂低亲和力状态。当使用[3H]5-HT作为放射配体时,劳沃叶皂苷被确定对人类受体具有相对较高的亲和力(Ki人=14.3+/-1.2 nM,而Ki大鼠=35.8+/-3.8 nM)。由于没有已知的高亲和力拮抗剂可用作放射性配体,因此进行了这些研究,以表征[3H]劳沃叶皂苷作为AV12细胞中表达的克隆人5-HT2B受体的放射性配体。当[3H]rauwolscine最初被测试作为放射性配体的有用性时,得到了复杂的竞争曲线。在测试了几种α2肾上腺素能配体后,确定AV12细胞中存在[3H]rauwolscine结合的成分,这是由于内源性α2肾上腺素受体的存在。发现α2肾上腺素能配体依法氧嘧啶可以阻断[3H]劳沃叶皂苷与α2肾上腺素受体的结合,而不会显著影响其与5-HT2B受体的结合。因此,该药物被纳入所有后续研究。在37摄氏度的饱和研究中,[3H]劳沃叶皂苷标记了单个结合位点群体,Kd=3.75+/-0.23 nM。在使用相同组织样本的同时实验中,[3H]劳沃叶皂苷标记了783+/-10fmol的5-HT2B受体/mg蛋白质,而[3H]5-HT结合标记了733+/-14fmol的5-HT2B受体/mg蛋白质。在0摄氏度时,[3H]5-HT结合的条件应主要标记人类5-HT2B受体的激动剂高亲和力状态,[3H]劳沃叶皂苷(Bmax=951+/-136fmol/mg)再次标记的受体明显多于[3H]5-HT(Bmax=615+/-34fmol/mg)。[3H]rauwolscine在0摄氏度时对人5-HT2B受体的亲和力没有变化,Kd=4.93+/-1.27 nM,而对[3H]5-HT的亲和力大大增加(37摄氏度时的Kd=7.76+/-1.06 nM;0摄氏度下的Kd=0.0735+/-0.0081 nM)。当使用[3H]rauwolscine作为放射性配体时,拮抗剂结构的竞争曲线模拟为单个结合位点,而激动剂竞争通常会产生最适合双位点结合模型的曲线。此外,当[3H]rauwolscine作为放射性配体时,许多具有拮抗剂结构的化合物对5-HT2B受体显示出更高的亲和力。通常,约85%的[3H]rauwolscine结合是特异性结合。这些研究表明[3H]rauwolscine作为克隆的人5-HT2B受体的拮抗剂放射性配体是有用的。这应该为研究人类克隆的5-HT2B受体的激动剂高亲和力和低亲和力状态提供一个很好的工具[2]。 |
| 细胞实验 |
α2肾上腺素能拮抗剂[3H]rauwolscine以相当的纳摩尔亲和力与人类额叶皮层膜中的α2肾上腺素受体和非肾上腺素能5-HT1A受体位点结合。在培养基中加入0.5 mM GTP会显著减少[3H]劳沃叶皂苷结合位点的数量(在GTP存在和不存在的情况下,Bmax分别为230+/-16和115+/-11fmol/mg蛋白质)。[3H]rauwolscine的亲和力保持不变(即KD=40+/-0.9 nM和4.1+/-1 nM)。GTP的这种作用可归因于放射性配体与5-HT1A受体的结合减少。GTP将[3H]rauwolscine的结合降低到与人类额叶皮层和海马膜中α2肾上腺素受体对应的水平几乎相同的水平。与α2肾上腺素受体相比,海洋锥蜗牛(Conus tessulatus)的毒液优先抑制[3H]rauwolscine与5-HT1A受体的结合。这种毒液完全掩盖了5-HT1A受体。GTP不再影响[3H]rauwolscine对其余α2肾上腺素受体的饱和结合特性。核苷酸以一定的效力(即GTPγS大于GPP(NH)P,远大于GDP,远大于GTP,远大于ATP)降低[3H]劳沃叶皂苷与5-HT1A受体的结合,这是核苷酸介导的受体-G蛋白解离的典型特征。这表明[3H]rauwolscine是一种5-HT1A受体激动剂,这一结论与早期的功能研究一致,表明rauwolscene(以及育亨宾)在5-HT自身受体水平上具有激动作用[2]。
|
| 动物实验 |
The alpha 2 agonist clonidine has been shown to be anxiolytic in a number of preclinical anxiety models. Interestingly, intravenous infusion of the alpha 2 antagonists idazoxan at 10 mg/kg and rauwolscine at 2.24 mg/kg significantly disinhibited lick-shock conflict responding in rats similar to the alpha 2 agonist clonidine (0.022 mg/kg) and the benzodiazepine diazepam (0.5 mg/kg). However, the alpha 2 antagonists yohimbine and piperoxan, the alpha 2 agonists medetomidine, guanfacine, and guanabenz, the non-specific alpha antagonist phentolamine, and the alpha 1 antagonist prazosin did not disinhibit conflict responding in the Vogel lick-shock paradigm. In fact, yohimbine has been shown to be anxiogenic in both animals and man. This may be due to yohimbine's lack of specificity and its ability to inhibit GABAergic release. In addition, all of these agents, except idazoxan, did not increase water consumption in water deprived rats. Idazoxan (10 mg/kg) significantly decreased water consumption by 45%. Therefore, idazoxan increased conflict responding for water reward at a dose (10 mg/kg) which also decreased water consumption in a non-conflict paradigm. These data suggest that agents with selective antagonism at the alpha 2 receptor site may be anxiolytic while agents with less specificity at this site such as yohimbine, piperoxan, and phentolamine are not anxiolytic.Life Sci
. 1994;54(10):PL179-84. doi: 10.1016/0024-3205(94)00556-7.
|
| 毒性/毒理 (Toxicokinetics/TK) |
mouse LDLo oral 125 mg/kg
|
| 参考文献 |
|
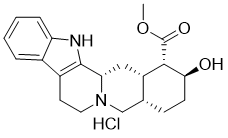
| 分子式 |
C21H26N2O3.CLH
|
|---|---|
| 分子量 |
390.90400
|
| 精确质量 |
390.171
|
| 元素分析 |
C, 64.52; H, 6.96; Cl, 9.07; N, 7.17; O, 12.28
|
| CAS号 |
6211-32-1
|
| 相关CAS号 |
Yohimbine Hydrochloride;65-19-0;Rauwolscine;131-03-3; 6211-32-1 (HCl); 28834-05-1 (phosphate)
|
| PubChem CID |
197067
|
| 外观&性状 |
White to off-white solid powder
|
| 密度 |
1.31 g/cm3
|
| 沸点 |
543ºC at 760 mmHg
|
| 熔点 |
270-280ºC
|
| 闪点 |
282.2ºC
|
| LogP |
3.387
|
| tPSA |
65.56
|
| 氢键供体(HBD)数目 |
3
|
| 氢键受体(HBA)数目 |
4
|
| 可旋转键数目(RBC) |
2
|
| 重原子数目 |
27
|
| 分子复杂度/Complexity |
555
|
| 定义原子立体中心数目 |
5
|
| InChi Key |
PIPZGJSEDRMUAW-ZKKXXTDSSA-N
|
| InChi Code |
InChI=1S/C21H26N2O3.ClH/c1-26-21(25)19-15-10-17-20-14(13-4-2-3-5-16(13)22-20)8-9-23(17)11-12(15)6-7-18(19)24;/h2-5,12,15,17-19,22,24H,6-11H2,1H3;1H/t12-,15+,17+,18+,19+;/m1./s1
|
| 化学名 |
methyl (1S,15S,18S,19S,20S)-18-hydroxy-1,3,11,12,14,15,16,17,18,19,20,21-dodecahydroyohimban-19-carboxylate;hydrochloride
|
| 别名 |
Rauwolscine hydrochloride; 6211-32-1; alpha-Yohimbine hydrochloride; Rauwolscine HCl; PQ323MIB24; Fauwolscine, hydrochloride; Methyl (16beta,17alpha,20alpha)-17-hydroxyyohimban-16-carboxylate hydrochloride; Rauwolscine (hydrochloride);
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中,避免吸湿/受潮。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~12.5 mg/mL (~31.98 mM)
H2O : ~5 mg/mL (~12.79 mM) |
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.5582 mL | 12.7910 mL | 25.5820 mL | |
| 5 mM | 0.5116 mL | 2.5582 mL | 5.1164 mL | |
| 10 mM | 0.2558 mL | 1.2791 mL | 2.5582 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT00734422 | COMPLETED | Behavioral: Virtual Reality Exposure Therapy | Phobic Disorders | VU University of Amsterdam | 2008-07 | Phase 2 Phase 3 |
| NCT04346394 | WITHDRAWN | Drug: Yohimbine HCl | Parkinson Disease | Nathaniel M. Robbins | 2021-05-11 | Early Phase 1 |
| NCT00975325 | COMPLETED | Drug: Yohimbine Drug: Yohimbine |
Erectile Dysfunction | Walter Ritter GmbH & Co | 2009-10 | Phase 4 |
| NCT00958880 | COMPLETEDWITH RESULTS | Behavioral: Group Cognitive Behavioral Therapy Drug: Yohimbine Hydrochloride Drug: Sugar Pill |
Social Anxiety Disorder | Southern Methodist University | 2009-03 | Phase 3 |
| NCT06430580 | NOT YET RECRUITING | Drug: Hydrocortisone Oral Drug: Yohimbine Hydrochloride Drug: Cornstarch Placebo 20mg Drug: Cornstarch Placebo 54mg |
Cannabis Use Disorder | Auburn University | 2024-08-15 | Early Phase 1 |