| 规格 | 价格 | |
|---|---|---|
| 500mg | ||
| 1g | ||
| Other Sizes |
| 靶点 |
Neuraminidase
|
|---|---|
| 体外研究 (In Vitro) |
尿石素M5的体外活性[1]
最初使用MTT法在MDCK细胞上评估尿石素M5的细胞毒性。尿石素M5的CC50值为227.4μM(图1a)。进行斑块减少测定以发现尿石素M5对金刚烷胺耐药菌株A/WSN/33(H1N1)(WSN)、奥司他韦耐药菌株A/California/7/2009(H1N1)、A/PR/8/34(H1N1)和A/neneneba香港/1/68(H3N2)(HK68)的抑制。如图1b所示,尿石素M5以剂量依赖的方式抑制了所有四种菌株。值得注意的是,25μM的尿石素M5抑制了所有病毒的生长,表明与GLY、金丝雀苷A、B和C中的其他植物化学物质相比,尿石素M6是最有效的化合物,IC50范围为3.74至16.51μM。 尿石素M5在附着阶段不起作用[1] 为了研究尿石素M5是否通过与病毒附着相互作用而发挥抗流感病毒活性,进行了血凝抑制试验。在该试验中,流感病毒可以通过形成格子来诱导鸡红细胞中的血凝素。这是由于HA1单元和宿主唾液酸受体的相互作用。在没有WSN的情况下,尿石素M5治疗导致U形底部反应孔出现红斑(图S5)。WSN在5-500μM尿石素M5或PBS对照处理中显示晶格外观。PGG作为阳性对照,可以中断血凝并产生红细胞红斑。作为阴性对照,奥司他韦对晶格外观没有影响。这些结果表明,尿结石蛋白M5对HA1没有活性。 尿锂素M5抑制NA活性[1] 使用NA底物MUNANA测试尿石素M5对NA的影响。MUNANA和IAV的反应产生了荧光信号化合物4-甲基伞形酮。将10、100、125、250、500和1000μM的尿石素M5加入反应孔中,并使用10倍稀释的奥司他韦酸作为该试验的阳性对照(耐药菌株pdm09除外)。如图2所示,尿石素M5可以抑制NA活性,IC50为243.2μM(WSN)、191.5μM(pdm)、257.1μM(PR8)和174.8μM(HK68)。 |
| 体内研究 (In Vivo) |
尿石素M5提高小鼠存活率[1]
在小鼠模型中检查了尿石素M5的体内作用。其剂量是根据尿结石家族体内剂量的报告决定的。一般来说,感染的小鼠在第10天之前体重都会下降,然后全部死亡。从图3b的结果来看,尿石素M5和奥司他韦组的体重在第9天反弹。总计200mg/kg/d的M5尿石素治疗将存活率提高到50%,明显高于赋形剂组(图3a)。这些结果表明,200mg/kg/d的尿石素M5对PR8感染的小鼠具有保护作用。 尿石素M5降低肺指数和肺病毒载量[1] 每组选取6只小鼠,在感染后第四天随机处死,以获得其肺指数和肺病毒滴度。与赋形剂组相比,尿石素M5治疗将肺指数从1.445降低到0.8875(图3c),表明肺水肿有所改善。从图3d可以看出,肺病毒滴度降低了0.52 log,这与细胞模型中尿石素M5治疗的抗流感病毒作用相吻合。 尿石素M5降低小鼠肺细胞因子表达[1] 流感病毒感染可引起肺部炎症风暴,表现为细胞因子的过表达。为了确定尿石素M5治疗后的炎症标志物,在接种后第4天对小鼠肺部右侧进行匀浆,并评估NF-κB、TNF-α和IL-6的表达水平。如图4a所示,载体组中三种细胞因子上调。奥司他韦和尿石素M5治疗均能减少细胞因子的产生。Urolitin M5在调节NF-κB水平方面的表现优于奥司他韦。 尿石素M5减少肺部病理[1] 检查感染后第四天收集的肺组织左侧部分,以确定组织病理学变化。如图4b所示,苏木精和伊红染色后观察到炎症变化,包括间质扩张、水肿和小血管周围炎性细胞浸润。奥司他韦治疗后,小血管和支气管周围的渗出物显著减少。尿石素M5治疗后,支气管损伤减少,炎性细胞减少,但小血管周围仍可见炎性细胞浸润。这些结果表明,尿石素M5治疗减轻了流感病毒感染的肺部病理和病变。 |
| 酶活实验 |
血凝抑制试验[1]
用红细胞和WSN病毒进行血凝抑制试验。将WSN(4HA单元)和两倍稀释的F2-3-4-6加入U形底板中并稍微混合。在37°C下孵育30分钟后,新鲜制备0.05%的鸡红细胞PBS溶液,并将其加入反应孔中。在室温下孵育30分钟后,可以观察到血凝。五加酰葡萄糖(PGG)用作阳性对照,奥司他韦酸用作阴性对照。包括没有病毒溶液的反应孔,以确认化合物对鸡红细胞的影响。进行了三次平行验证。 神经氨酸酶抑制试验[1] 为了确认F2-3-4-6对流感病毒NA的抑制作用,使用MUNANA和四种不同的病毒株进行NA抑制试验。分别制备MES缓冲液和MUNANA。黑色96孔板(Costar)的每个反应孔含有30 mM MES缓冲液、病毒溶液、F2-3-4-6稀释液和蒸馏水,体积为90μL。在37°C下孵育30分钟后,立即向每个孔中加入10μL 1 mM MUNANA溶液。在37°C下30分钟后,用CLARIOstar多模微孔板读数器测量每个孔的荧光强度(F),激发波长为322 nm,发射波长为450 nm。奥司他韦酸用作阳性对照,并进行了三次平行实验以确认。F2-3-4-6对NA活性的抑制作用通过以下公式计算: NA抑制率(%)=(Fcontrol−Fcompound)/(Fcontrol-Fblank)×100% |
| 细胞实验 |
细胞毒性试验[1]
使用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT)法评估F2-3-4-6的细胞毒性。接种在96孔板上的单层MDCK细胞在无FBS的MEM中用两倍稀释的F2-3-4-6处理。在37°C下孵育48小时后,将新鲜制备的PBS中的MTT加入每个孔中。孵育4小时后,去除上清液,每孔加入100μL DMSO以溶解甲酰胺晶体。重复该测定三次以进行确认。使用ClarioStar微孔板读数器测量570nm处的吸光度。CC50被定义为产生50%细胞毒性作用的浓度。 病毒感染和滴度[1] 将6孔板上的MDCK细胞用PBS洗涤,将病毒溶液A/WSN/33(H1N1)(WSN)、A/PR/8/34(H1N1)、A/California/7/2009(H1N1)或A/neneneba香港/1/68(H3N2)(HK68)稀释10倍,以1000μL/孔加入MDCK细胞中。在37°C下孵育2小时后,单层细胞用不含FBS的MEM包被,MEM含有2μg/mL TPCK处理的胰蛋白酶(WSN感染不需要)和1%融化的琼脂糖在PBS中。感染48小时后,去除琼脂糖塞,用染色溶液(0.25%考马斯亮蓝、10%乙酸、50%甲醇)对细胞进行染色。在方法4.7中测定产生200个斑块形成单位(PFU)的稀释度并用于感染。 菌斑减少试验[1] 将MDCK细胞接种在6孔板上并孵育过夜。将汇合的MDCK细胞用PBS洗涤,并用200PFU的A/WSN/33(H1N1)(WSN)、A/PR/8/34(H1N1)、A/California/7/2009(H1N1)或A/neneneba香港/1/68(H3N2)(HK68)感染。F2-3-4-6用新鲜制备的不含FBS的MEM稀释两倍,MEM含有2μg/mL TPCK处理的胰蛋白酶(WSN感染不需要)。在37°C下孵育2小时后,单层细胞被F2-3-4-6溶液和1%融化的琼脂糖在PBS中的混合物包裹。感染48小时后,去除琼脂糖塞,用染色溶液(0.25%考马斯蓝、10%乙酸、50%甲醇)对细胞进行染色。重复该测定三次以进行确认。抑制50%病毒诱导的鼠疫的F2-3-4-6浓度被确定为IC50(50%抑制浓度)。 |
| 动物实验 |
Anti-Influenza Virus Test in Mouse Model [1]
Mice were divided randomly into four groups, with 12 mice per group. The F2-3-4-6, oseltamivir, and vehicle groups were intranasally infected with 2 MLD50 of PR8 in a volume of 20 μL. The F2-3-4-6 groups were orally administered 200 mg/kg/day of F2-3-4-6. The oseltamivir group were orally administered oseltamivir at 65 mg/kg/d as a positive control. The control and vehicle groups were treated with 0.5% CMC solution only. Herb treatment was administered once a day for six consecutive days. Body weights were recorded for 16 consecutive days. |
| 参考文献 | |
| 其他信息 |
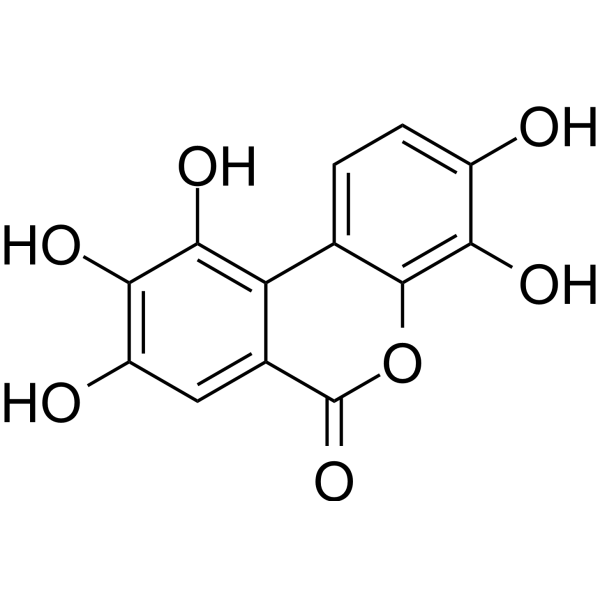
3,4,8,9,10-Pentahydroxybenzo[c]chromen-6-one has been reported in Lagerstroemia speciosa, Punica granatum, and other organisms with data available.
Ganlanye, the leaves of Canarium album (Lour.) DC., were recorded as a major traditional herb for warm disease treatment. In our study, urolithin M5 was identified as a potent anti-influenza virus agent from this herb. Our research provides scientific evidence for the application of GLY in influenza treatment and improves public confidence to traditional medicine. [1] |
| 分子式 |
C13H8O7
|
|---|---|
| 分子量 |
276.20
|
| 精确质量 |
276.027
|
| CAS号 |
91485-02-8
|
| PubChem CID |
18504424
|
| 外观&性状 |
White to off-white solid powder
|
| 密度 |
1.894±0.06 g/cm3 (20 °C, 760 mmHg)
|
| 沸点 |
727.4±60.0 °C (760 mmHg)
|
| LogP |
1.474
|
| tPSA |
131.36
|
| 氢键供体(HBD)数目 |
5
|
| 氢键受体(HBA)数目 |
7
|
| 可旋转键数目(RBC) |
0
|
| 重原子数目 |
20
|
| 分子复杂度/Complexity |
400
|
| 定义原子立体中心数目 |
0
|
| SMILES |
O=C1C2C(=C(C(=C(C=2)O)O)O)C2C(=C(C(=CC=2)O)O)O1
|
| InChi Key |
ZELMDXUEWHBWPN-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C13H8O7/c14-6-2-1-4-8-5(3-7(15)9(16)11(8)18)13(19)20-12(4)10(6)17/h1-3,14-18H
|
| 化学名 |
3,4,8,9,10-pentahydroxybenzo[c]chromen-6-one
|
| 别名 |
urolithin M5; 91485-02-8; 3,4,8,9,10-Pentahydroxybenzo[c]chromen-6-one; 3,4,8,9,10-Pentahydroxy-6H-dibenzo[b,d]pyran-6-one; 3,4,8,9,10-Pentahydroxyurolithin; Decarboxyellagic Acid;; SCHEMBL2357304; 3,4,8,9,10-pentahydroxydibenzo[b,d]pyran-6-one;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
Typically soluble in DMSO (e.g. 10 mM)
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.6206 mL | 18.1028 mL | 36.2056 mL | |
| 5 mM | 0.7241 mL | 3.6206 mL | 7.2411 mL | |
| 10 mM | 0.3621 mL | 1.8103 mL | 3.6206 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。