| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| 1g |
|
||
| Other Sizes |
|
| 靶点 |
IDO1 (IC50 = 38 nM)
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
强 IDO1 抑制剂 IDO-IN-7(NLG-919 的类似物)的 IC50 为 38 nM。 IDO-IN-7 与 IDO1 的结合模式可通过实验获得,并展示了与铁血红素第六配位位点的直接配位相互作用。在之前的研究中,IDO-IN-7被用作参考药物来构建免疫刺激纳米胶束载体并验证IDO1抑制的高通量筛选试验[1]。
|
||
| 体内研究 (In Vivo) |
在小鼠中,单次口服 NLG919 可使血浆和组织 Kyn 浓度降低约 50%。在携带 B16F10 肿瘤的小鼠中,NLG919 显着增强了初始静息 pmel-1 细胞对 IFA 中同源 hgp100 肽加 CpG-1826 疫苗接种的抗肿瘤反应。
|
||
| 酶活实验 |
微尺度热泳(MST)[1]
热电泳是生物分子复合物在温度梯度中的运动,取决于尺寸、电荷和水合壳,这些通常在配体/靶相互作用时发生变化。MST实验基于使用16根毛细管,这些毛细管填充有荧光染料标记的靶蛋白和未标记配体的连续滴定。然后用红外激光照射毛细管,产生温度梯度。蛋白质/配体复合物沿着该梯度迁移,导致观察到的荧光发生变化。这些用于生成作为配体浓度函数的结合曲线,然后对其进行分析以评估Kd值。 按照染料NT647与赖氨酸残基的N-羟基琥珀酰亚胺(NHS)偶联方案对rhIDO1进行荧光标记。简而言之,将100μL 9.95μM rhIDO1蛋白在标记缓冲液(130 mM NaHCO3,50 mM NaCl,pH 8.2)中的溶液与100μL 39.8μM NT647-NHS荧光团在标记缓冲区中混合,并在室温(RT)下在黑暗中孵育30分钟。通过尺寸排阻色谱法去除未结合的荧光团,使用MST缓冲液(50 mM TRIS,150 mM NaCl,10 mM MgCl2,pH 7.4,0.05%吐温20)作为运行缓冲液。样品中每种元素的实际浓度,如蛋白质、血红素基团和红色染料,以及标记程度(DOL)是通过使用消光系数ɛ280=51380 M−1 cm−1(rhIDO1)、\603 405=159000 M−2 cm−2(rhID01血红素基团)和\603 650=250000 M−3 cm−3(NT647荧光团)来确定的,在280 nm处,Fcorr的校正系数为0.028,使用Cprot=[A280-(A280 x Fcorr)/\603 280 x l],在所有标记反应中DOL的结果在0.6到0.8之间。 使用圆二色性检查NT647-rhIDO1和未修饰的rhIDO1蛋白的稳定性。在室温(≈22°C)下,使用Jasco810分光光度计和1mm光程石英比色皿记录两种蛋白质的光谱。灵敏度为100毫度,扫描速度为20 nm/min,累计2次扫描。在磷酸盐缓冲液(PPB;50 mM K2HPO4,pH 7.4)中,以0.1 mg/ml的浓度在180至260 nm之间收集两个样品的CD数据。用CDNN 2.1软件对光谱进行反卷积。结果见补充材料(表S1)。 使用优质涂层毛细管和包含2%DMSO和2mM DTT的MST缓冲液进行化合物筛选。DMSO中的化合物储备(50 mM)在测定缓冲液中稀释至500μM或1 mM的最终最大浓度,具体取决于化合物的溶解度。通过在PCR管(由NanoTemper Technologies提供)中含有4%DMSO的测定缓冲液中以1:1的比例连续稀释16倍,制备用于MST实验的化合物预稀释液,最终体积为10μL。制备浓度为90 nM的NT647-rhIDO1溶液,并将10μL该溶液加入到每种化合物稀释液中,使NT647-rh IDO1的最终浓度为45 nM,反应体积为20μL。将这些样品装入16根优质涂层毛细管中,并插入MST仪器(Monolith NT.115)的芯片托盘中,用于热泳分析和Kd值评估。MST信号记录为MST 40%(化合物7、9、10、23、28)。在MST 80%下测试了在40%(8,11-22,24-27,29)下没有提供良好信噪比结合曲线的化合物。在这两种情况下,都使用了20%的LED电源。Kd值由NT647-rhIDO1在MST 40%下热泳21秒后和MST 80%下热泳4秒后归一化荧光(Fnorm)的化合物浓度依赖性变化计算得出。每种化合物在三份样品中进行测试,并使用MO亲和分析软件(NanoTemper Technologies)分析数据。每种测试化合物的Kd值旁边都标明了置信度值(±)。具体来说,置信度值定义了Kd以68%的确定性下降的范围。每个片段的结合效率指数(BEI)用以下方程式计算:(方程式1)BEI=pKd/MW。 |
||
| 细胞实验 |
细胞测定[1]
P1.HTR是小鼠肥大细胞瘤P815的高度可转染克隆变体,在添加了10%FCS的Iscove改良Dulbecco's培养基中培养。用编码小鼠IDO1的质粒构建体(P1.IDO1)通过电穿孔转染P1.HTR细胞。通过嘌呤霉素筛选获得稳定的转染细胞系。将浓度为0.1×106个细胞/ml的细胞与30μM的化合物一起孵育16小时。对照组由用等体积的DMSO(化合物溶解的载体)孵育的细胞表示。孵育后,回收细胞培养上清液,用HPLC检测犬尿氨酸浓度。通过相同的细胞测定建立剂量反应曲线,从30μM开始用一系列稀释的分子孵育P1.IDO1细胞。所有实验都进行了三次,重复了近两次。结果表示为犬尿氨酸倍数变化(l-Kyn FC)的平均值±标准差,即化合物处理细胞与载体处理细胞上清液中分泌的犬尿氨素浓度之比。 |
||
| 动物实验 |
|
||
| 参考文献 | |||
| 其他信息 |
Indoleamine 2,3-dioxygenase 1 (IDO1) is attracting a great deal of interest as drug target in immune-oncology being highly expressed in cancer cells and participating to the tumor immune-editing process. Although several classes of IDO1 inhibitors have been reported in literature and patent applications, only few compounds have proved optimal pharmacological profile in preclinical studies to be advanced in clinical trials. Accordingly, the quest for novel structural classes of IDO1 inhibitors is still open. In this paper, we report a fragment-based screening campaign that combines Water-LOGSY NMR experiments and microscale thermophoresis approach to identify fragments that may be helpful for the development of novel IDO1 inhibitors as therapeutic agents in immune-oncology disorders.[1]
Purpose: Breast cancer has become a major public health threat in the current society. Anthracycline doxorubicin (DOX) is a widely used drug in breast cancer chemotherapy. We aimed to investigate the immunogenic death of breast tumor cells caused by DOX, and detect the effects of combination of DOX and a small molecule inhibitor in tumor engrafted mouse model.[2] Methods: We used 4T1 breast cancer cells to examine the anthracycline DOX-mediated immunogenic death of breast tumor cells by assessing the calreticulin exposure and adenosine triphosphate and high mobility group box 1 release. Using 4T1 tumor cell-engrafted mouse model, we also detected the expression of indoleamine 2,3-dioxygenase (IDO) in tumor tissues after DOX treatment and further explored whether the specific small molecule IDO1 inhibitor NLG919 combined with DOX, can exhibit better therapeutic effects on breast cancer. [2] Results: DOX induced immunogenic cell death of murine breast cancer cells 4T1 as well as the upregulation of IDO1. We also found that treatment with NLG919 enhanced kynurenine inhibition in a dose-dependent manner. IDO1 inhibition reversed CD8+ T cell suppression mediated by IDO-expressing 4T1 murine breast cancer cells. Compared to the single agent or control, combination of DOX and NLG919 significantly inhibited the tumor growth, indicating that the 2 drugs exhibit synergistic effect. The combination therapy also increased the expression of transforming growth factor-β, while lowering the expressions of interleukin-12p70 and interferon-γ. [2] Conclusion: Compared to single agent therapy, combination of NLG919 with DOX demonstrated better therapeutic effects in 4T1 murine breast tumor model. IDO inhibition by NLG919 enhanced the therapeutic efficacy of DOX in breast cancer, achieving synergistic effect.[2] |
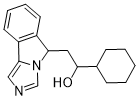
| 分子式 |
C18H22N2O
|
|
|---|---|---|
| 分子量 |
282.38
|
|
| 精确质量 |
282.173
|
|
| 元素分析 |
C, 76.56; H, 7.85; N, 9.92; O, 5.67
|
|
| CAS号 |
1402836-58-1
|
|
| 相关CAS号 |
|
|
| PubChem CID |
66558287
|
|
| 外观&性状 |
White to khaki solid powder
|
|
| 密度 |
1.3±0.1 g/cm3
|
|
| 沸点 |
524.6±33.0 °C at 760 mmHg
|
|
| 闪点 |
271.1±25.4 °C
|
|
| 蒸汽压 |
0.0±1.4 mmHg at 25°C
|
|
| 折射率 |
1.676
|
|
| LogP |
3.28
|
|
| tPSA |
38.05
|
|
| 氢键供体(HBD)数目 |
1
|
|
| 氢键受体(HBA)数目 |
2
|
|
| 可旋转键数目(RBC) |
3
|
|
| 重原子数目 |
21
|
|
| 分子复杂度/Complexity |
355
|
|
| 定义原子立体中心数目 |
0
|
|
| InChi Key |
YTRRAUACYORZLX-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C18H22N2O/c21-18(13-6-2-1-3-7-13)10-16-14-8-4-5-9-15(14)17-11-19-12-20(16)17/h4-5,8-9,11-13,16,18,21H,1-3,6-7,10H2
|
|
| 化学名 |
1-cyclohexyl-2-(5H-imidazo[5,1-a]isoindol-5-yl)ethanol
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (8.85 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (8.85 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (8.85 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: ≥ 2.5 mg/mL (8.85 mM) (饱和度未知) in 10% EtOH + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL 澄清 EtOH 储备液加入400 μL PEG300 中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL 生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 5 中的溶解度: ≥ 2.5 mg/mL (8.85 mM) (饱和度未知) in 10% EtOH + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将100μL 25.0mg/mL澄清EtOH储备液加入到900μL 20%SBE-β-CD生理盐水中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 配方 6 中的溶解度: ≥ 2.5 mg/mL (8.85 mM) (饱和度未知) in 10% EtOH + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL 澄清乙醇储备液加入到 900 μL 玉米油中并混合均匀。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.5413 mL | 17.7066 mL | 35.4133 mL | |
| 5 mM | 0.7083 mL | 3.5413 mL | 7.0827 mL | |
| 10 mM | 0.3541 mL | 1.7707 mL | 3.5413 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT05469490 | Withdrawn | Radiation: Stereotactic Body Radiotherapy (SBRT) |
Advanced Solid Tumors | Luke, Jason, MD | October 2022 | Phase 1 |
 |
|---|