| 规格 | 价格 | |
|---|---|---|
| 500mg | ||
| 1g | ||
| Other Sizes |
| 靶点 |
COX-1
COX-1/2
|
|---|---|
| 体外研究 (In Vitro) |
在人关节软骨细胞中,阿司匹林锂抑制 COX-1 和 COX-2,IC50 值分别为 3.57 μM 和 29.3 μM [2]。阿司匹林锂通过乙酰化 COX-1 的丝氨酸 530,抑制血小板中血栓素 A 的产生,降低血小板聚集 [3]。通过阻止 CCAAT/增强子结合蛋白 β (C/EBPbeta) 附着到 COX-2 启动子/增强子上的适当位置,阿司匹林锂可抑制 COX-2 蛋白的表达 [3]。在转染的 T 细胞中,阿司匹林锂以 NF-κB 依赖性方式抑制 lgκ 增强子和 HIV 长末端重复序列 (LTR) 的转录 [4]。通过触发 caspase、p38 MAP 激酶、线粒体细胞色素 c 释放和神经酰胺途径,阿司匹林锂可引起细胞凋亡 [6]。
|
| 体内研究 (In Vivo) |
在患有酵母菌热的成年雄性大鼠中,阿司匹林锂(5-150 mg/kg,口服,一次)表现出很强的解热作用[7]。
|
| 酶活实验 |
转录因子核因子κB(NF-kappa B)对于参与炎症和感染的多种细胞和病毒基因的诱导表达至关重要,包括白细胞介素-1(IL-1)、IL-6和粘附分子。抗炎药水杨酸钠和阿司匹林抑制了NF-κB的激活,这进一步解释了这些药物的作用机制。这种抑制阻止了NF-κB抑制剂IκB的降解,因此NF-κB保留在细胞质中。水杨酸钠和阿司匹林还抑制了转染T细胞中Igκ增强子和人类免疫缺陷病毒(HIV)长末端重复序列(LTR)的NF-κB依赖性转录。[4]
阿司匹林通过永久乙酰化形成前列腺素的环氧化酶来抑制血小板功能。我们通过测量阿司匹林摄入后不同时间获得的洗涤血小板中[3H-乙酰基]阿司匹林敏感性环氧化酶,确定了正常受试者血小板对阿司匹林的敏感性。单次服用325毫克阿司匹林可灭活89%的血小板环氧化酶。抑制持续2天,表明口服阿司匹林也灭活了巨核细胞环氧化酶。此后,活性酶随着反映血小板更新的时间进程而恢复(寿命8.2+/-2天)。单次剂量20-650mg阿司匹林在24小时后产生34%-95%以上的抑制作用。在停药后24小时测量时,短期内每日剂量20-325mg阿司匹林产生61%-95%以上失活。血小板环氧化酶对阿司匹林失活的敏感性高于绵羊精囊中的酶。[4] |
| 动物实验 |
Animal/Disease Models: Male albino Charles River rats (200-250 g, 8 rats/group, use 20 ml/kg 20% beer yeast aqueous suspension to induce fever, subcutaneously (sc) (sc) injected on the back below the nape of the neck) [7]
Doses: 5, 25, 50, 100 and 150 mg/kg Doses: po (po (oral gavage)) once Experimental Results: The 150 mg/kg dose produced a statistically significant decrease of 0.23°C 15 minutes after dosing. The antipyretic effect gradually increased until reaching a peak value of 1.96°C 120 minutes after administration. The ED50 of aspirin is 10.3 mg/kg, with a confidence limit of 1.8-23.0 mg/kg. The antipyretic response of aspirin depends on the dose of the compound administered. |
| 参考文献 |
[1]. Mitchell JA, et al. Selectivity of nonsteroidal antiinflammatory drugs as inhibitors of constitutive and induciblecyclooxygenase. Proc Natl Acad Sci U S A. 1993 Dec 15;90(24):11693-7.
[2]. Blanco FJ, et al. Effect of antiinflammatory drugs on COX-1 and COX-2 activity in human articular chondrocytes. J Rheumatol. 1999 Jun;26(6):1366-73. [3]. Wu KK, et al. Aspirin and other cyclooxygenase inhibitors: new therapeutic insights. Semin Vasc Med. 2003 May;3(2):107-12. [4]. Kopp E, et al. Inhibition of NF-kappa B by sodium salicylate and aspirin. Science. 1994 Aug 12;265(5174):956-9. [5]. Burch JW, et al. Inhibition of platelet prostaglandin synthetase by oral aspirin. J Clin Invest. 1978 Feb;61(2):314-9. [6]. Elwood PC, et al. Aspirin, salicylates, and cancer. Lancet. 2009 Apr 11;373(9671):1301-9. [7]. Loux JJ, DePalma PD, Yankell SL. Antipyretic testing of aspirin in rats. Toxicol Appl Pharmacol. 1972 Aug;22(4):672-5. |
| 其他信息 |
Evidence from a wide range of sources suggests that individuals taking aspirin and related non-steroidal anti-inflammatory drugs have reduced risk of large bowel cancer. Work in animals supports cancer reduction with aspirin, but no long-term randomised clinical trials exist in human beings, and randomisation would be ethically unacceptable because vascular protection would have to be denied to a proportion of the participants. However, opportunistic trials of aspirin, designed to test vascular protection, provide some evidence of a reduction in cancer, but only after at least 10 years. We summarise evidence for the potential benefit of aspirin and natural salicylates in cancer prevention. Possible mechanisms of action and directions for further work are discussed, and implications for clinical practice are considered.[6]
|
| 分子式 |
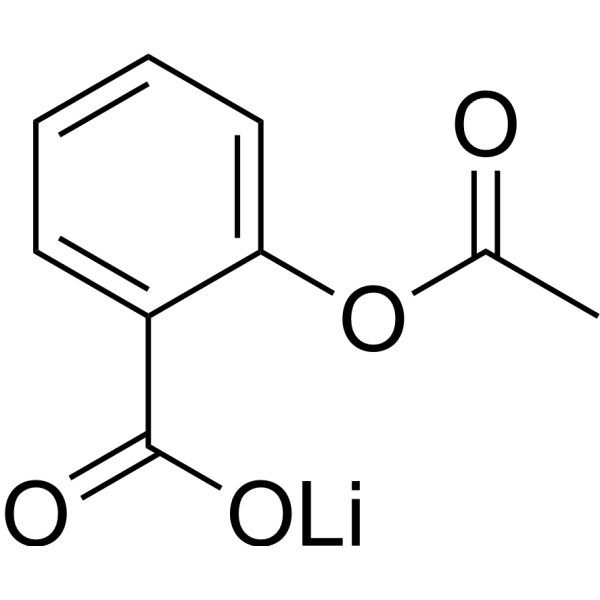
C9H7LIO4
|
|---|---|
| 分子量 |
186.09
|
| 精确质量 |
186.05
|
| 元素分析 |
C, 58.09; H, 3.79; Li, 3.73; O, 34.39
|
| CAS号 |
552-98-7
|
| 相关CAS号 |
Aspirin;50-78-2
|
| PubChem CID |
23680279
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| 沸点 |
321.4ºC at 760mmHg
|
| 闪点 |
131.2ºC
|
| tPSA |
66.43
|
| SMILES |
[Li+].CC(=O)OC1=CC=CC=C1C(=O)[O-]
|
| InChi Key |
FGLLQDSAOUJRST-UHFFFAOYSA-M
|
| InChi Code |
InChI=1S/C9H8O4.Li/c1-6(10)13-8-5-3-2-4-7(8)9(11)12;/h2-5H,1H3,(H,11,12);/q;+1/p-1
|
| 化学名 |
lithium;2-acetyloxybenzoate
|
| 别名 |
Lithium O-acetylsalicylate; 552-98-7; lithium 2-acetoxybenzoate; Aspirin (lithium); Acetylsalicylic acid, lithium salt; lithium;2-acetyloxybenzoate; 89R59534MK; Lithium acetylsalicylate
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体外实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 5.3737 mL | 26.8687 mL | 53.7374 mL | |
| 5 mM | 1.0747 mL | 5.3737 mL | 10.7475 mL | |
| 10 mM | 0.5374 mL | 2.6869 mL | 5.3737 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。