| 规格 | 价格 | |
|---|---|---|
| 500mg | ||
| 1g | ||
| Other Sizes |
| 靶点 |
K+-channel
|
|---|---|
| 体外研究 (In Vitro) |
基于黄嘌呤的KMUP-1被证明可以抑制磷酸二酯酶(PDE)并调节G蛋白偶联受体(GPCR),从而降低高脂血症和体重。本研究进一步探讨了KMUP-1是否影响3T3-L1前脂肪细胞的脂肪生成和脂肪分解。KMUP-1(1⁻40µM)浓度依赖性地减弱了油红O(ORO)染色,减少了甘油三酯(TG)的积累,表明3T3-L1细胞中的脂肪生成受到抑制。相比之下,β-激动剂莱克多巴胺增加了ORO染色和TG积累以及脂肪生成。KMUP-1(1⁻40µM)在脂肪生成阶段也降低了MAPKs/Akt/PPARγ表达、PPARγ1/PPARγ2 mRNA和p-ERK免疫反应性,但在脂肪分解阶段增强了激素敏感脂肪酶(HSL)免疫反应性。向脂肪细胞中添加蛋白激酶A(PKA)或蛋白激酶G(PKG)拮抗剂(KT5720或KT5728)不影响HSL免疫反应性。然而,KMUP-1确实增加了HSL的免疫反应性,PKA或PKG拮抗剂降低了这种作用。辛伐他汀、茶碱、咖啡因和西地那非,如KMUP-1,也能增强HSL的免疫反应性。磷酸化HSL(p-HSL)被KMUP-1增强,表明成熟3T3-L1脂肪细胞中的脂肪分解增加。脂肪生成过程中MAPKs/Akt/PPARγ的减少有助于抑制脂肪细胞分化,脂肪分解时PKA/PKG的增加有助于HSL活化和TG水解。综上所述,这些数据表明KMUP-1可以抑制3T3-L1脂肪细胞的高脂血症[1]。
|
| 体内研究 (In Vivo) |
STZ(链脲佐菌素)以时间过程依赖的方式降低了MAKATP电流,并在第14天实现了稳定的抑制。在STZ治疗的大鼠MASMC中,KMUP-1部分恢复了KATP电流,表明血管KATP通道被KMUP-1激活。K+(80mM KCl)诱导的STZ处理大鼠MA收缩高于对照组大鼠。KMUP-1显著减弱了STZ刺激的MA对高K+的收缩反应,表明KMUP-1可能部分恢复MA的血管反应性。此外,STZ降低了内皮型一氧化氮合酶(eNOS)的表达,这种作用被KMUP-1逆转,表明KMUP-1可以改善STZ诱导的血管内皮功能障碍。
结论:KMUP-1可预防STZ对MA反应性、eNOS水平和KATP通道的损伤,从而预防糖尿病大鼠的血管功能障碍[2]。 |
| 酶活实验 |
7-[2-[4-(2-氯苯基)哌嗪基]乙基]-1,3-二甲基黄嘌呤(KMUP-1)产生气管松弛、环核苷酸的细胞内积累、磷酸二酯酶(PDE)的抑制和K+通道的激活。KMUP-1(0.01-100微米)在用卡巴胆碱预收缩的豚鼠上皮完整气管中诱导浓度依赖性舒张反应。PDE抑制剂茶碱、3-异丁基-1-甲基黄嘌呤(IBMX)、米力农、罗利普兰和扎普利司特(100微米)以及KATP通道开放剂乙酰氯酮也引发了放松反应。通过去除上皮细胞和用可溶性鸟苷酸环化酶(sGC)抑制剂(1H-[1,2,4]恶二唑[4,3-a]喹喔啉-1-酮(ODQ),1微米)、一氧化氮合酶(Nomega-硝基-L-精氨酸甲酯,100微米)、K+通道(四乙基铵,10毫米)、KATP通道(格列本脲,1微米,电压依赖性K+通道,4-氨基吡啶,100微米,和Ca2+依赖性钾通道(charybdotoxin,0.1微米或apamin,1微米。KMUP-1(10微米)和茶碱均非选择性地轻微抑制PDE3、4和5的酶活性,表明它们能够抑制腺苷3',5'-环磷酸(环AMP)和鸟苷3',5'-环磷酸(环GMP)的代谢。同样,还测量了IBMX的影响,其对PDE3、4和5的IC50值分别为6.5+/-1.2、26.3+/-3.9和31.7+/-5.3微米。KMUP-1(0.01-10微米)提高了豚鼠培养的气管平滑肌细胞中的细胞内环AMP和环GMP水平。在腺苷酸环化酶抑制剂SQ 22536(100微米)和sGC抑制剂ODQ(10微米)的存在下,环AMP和环GMP的这些增加分别被消除。KMUP-1(10微米)以时间依赖的方式增加了蛋白激酶A(PKARI)和蛋白激酶G(PKG1alpha1beta)的表达,但这仅在9小时后对PKG有意义。气管内注射肿瘤坏死因子α(TNF-α,0.01mg kg(-1))诱导支气管收缩,并表现出肺阻力(RL)的时间依赖性增加和动态肺顺应性(Cdyn)的降低。在气管内注射TNF-α之前,静脉注射KMUP-1(1.0 mg/kg(-1))10分钟,逆转了RL和Cdyn的这些变化。这些数据表明,KMUP-1激活sGC,产生部分依赖于完整上皮的舒张作用,抑制PDE,增加细胞内环AMP和环GMP,从而增加PKA和PKG,导致K+通道打开,导致气管舒张[3]。
|
| 动物实验 |
Rats were divided into three groups: control, STZ (65 mg/kg, ip) and STZ + KMUP-1 (5 or 10 mg/kg/day, ip). MA reactivity was measured by dual wire myograph. MA smooth muscle cells (MASMCs) were enzymatically dissociated and the KATP currents recorded by a whole-cell patch-clamp technique.[2]
|
| 参考文献 |
[1]. Molecules.2018 Sep 23;23(10). pii: E2433;
[2]. Pharmacol Rep.2018 Aug;70(4):746-752. [3]. Br J Pharmacol. 2004 Aug;142(7):1105-14. |
| 其他信息 |
Potassium Ionophores:
Chemical agents that increase the permeability of CELL MEMBRANES to POTASSIUM ions.
|
| 分子式 |
C19H23N6O2CL
|
|
|---|---|---|
| 分子量 |
402.87792
|
|
| 精确质量 |
402.157
|
|
| 元素分析 |
C, 56.64; H, 5.75; Cl, 8.80; N, 20.86; O, 7.94
|
|
| CAS号 |
81996-46-5
|
|
| 相关CAS号 |
|
|
| PubChem CID |
10453764
|
|
| 外观&性状 |
Typically exists as solid at room temperature
|
|
| LogP |
0.912
|
|
| tPSA |
68.3
|
|
| 氢键供体(HBD)数目 |
0
|
|
| 氢键受体(HBA)数目 |
5
|
|
| 可旋转键数目(RBC) |
4
|
|
| 重原子数目 |
28
|
|
| 分子复杂度/Complexity |
599
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
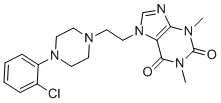
CN1C2=C(C(=O)N(C1=O)C)N(C=N2)CCN3CCN(CC3)C4=CC=CC=C4Cl
|
|
| InChi Key |
NIDVDYQCGWISJZ-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C19H23ClN6O2/c1-22-17-16(18(27)23(2)19(22)28)26(13-21-17)12-9-24-7-10-25(11-8-24)15-6-4-3-5-14(15)20/h3-6,13H,7-12H2,1-2H3
|
|
| 化学名 |
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.4821 mL | 12.4106 mL | 24.8213 mL | |
| 5 mM | 0.4964 mL | 2.4821 mL | 4.9643 mL | |
| 10 mM | 0.2482 mL | 1.2411 mL | 2.4821 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。