| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
Neutral sphingomyelinase (N-SMase) (IC50 = 1 μM)
|
|---|---|
| 体外研究 (In Vitro) |
GW4869 (10 μM) 部分抑制了 TNF 诱导的鞘磷脂 (SM) 水解,20 μM 的化合物完全阻止 SM 损失。添加10-20μM GW4869完全抑制了神经酰胺的初始积累;然而,这种效果在稍后的时间点(24 小时)部分消失。 GW4869 的作用先于谷胱甘肽的减少。 GW4869 以剂量依赖性方式显着抑制细胞死亡[1]。 GW4869(10 或 20 μM)可防止巨噬细胞产生促炎细胞因子和释放外泌体。多泡体 (MVB) 成熟外泌体的释放和神经酰胺介导的内出芽均受到 GW4869 的抑制 [2]。在肝星状细胞中,GW4869 还可以解除富含 miR-214 的外泌体引起的 CCN2 3'-UTR 活性抑制 [3]。溶解注意事项:GW4869 通常在 DMSO 中制备成储备溶液,并以等分试样储存在 -80°C 下。
对中性镁依赖性鞘磷脂酶(SMase)进行高通量筛选。筛选中发现的一种抑制剂,GW4869,在体外作为酶的非竞争性抑制剂发挥作用,IC(50)为1微米。在至少150微米的范围内,它不会抑制酸性SMase。然后评估该化合物抑制肿瘤坏死因子(TNF)诱导的MCF7细胞中性SMase(N-SMase)激活的能力GW4869(10微米)部分抑制了TNF诱导的鞘磷脂(SM)水解,20微米的化合物完全避免了SM的损失。添加10-20微米的GW4869完全抑制了神经酰胺的初始积累,而这种作用在以后的时间点(24小时)部分丧失。因此,这些数据支持GW4869不仅在体外而且在细胞模型中对N-Mase的抑制作用。添加10和20微米的GW4869会改变细胞对TNF的谷胱甘肽水平,这表明GW4869的作用发生在谷胱甘肽下降的下游,而谷胱甘肽下降之前被证明发生在N-Mase激活的上游。此外,尽管TNF治疗在孵育20小时后也导致从头合成的神经酰胺增加75%,但10或20微米的GW4869对神经酰胺产生的这一途径没有影响。此外,GW4869没有显著损害TNF诱导的NF-κB向细胞核的易位。因此,GW4869不会干扰其他关键的TNF介导的信号传导作用。GW4869能够以剂量依赖的方式显著保护细胞免于死亡,如核凝结、胱天蛋白酶激活、PARP降解和台盼蓝摄取所示。这些保护作用伴随着对线粒体细胞色素c释放和胱天蛋白酶9激活的显著抑制,因此将N-Mase激活定位在线粒体功能障碍的上游。总之,我们的结果表明,N-Mase激活是TNF诱导的细胞毒性程序充分发展的必要步骤。[1] GW4869抑制巨噬细胞中的外泌体释放和促炎细胞因子的产生[2] 接下来,我们试图确定阻断外泌体的产生是否会减少RAW264.7巨噬细胞中LPS介导的促炎反应GW4869已成功用于阻断HEK293细胞、心肌细胞、肝细胞和肺上皮细胞分泌外泌体。在这项研究中,我们用两种不同剂量的GW4869(10μM和20μM)治疗RAW264.7巨噬细胞。我们观察到,用10μM GW4869预处理巨噬细胞后,LPS引发的巨噬细胞外泌体生成显著减弱,AChE活性降低22%即可证明这一点(图3A)。用20μM GW4869处理后,这种衰减进一步增强(图3A)。为了测试GW4869可能的毒性,我们测量了暴露于10μM和20μM GW4869以及0.005%DMSO(用于溶解GW4869的溶液)24小时后巨噬细胞上清液中细胞损伤标志物乳糖酶脱氢酶(LDH)的水平。这表明0.005%的DMSO和GW4869对巨噬细胞没有毒性作用。对促炎细胞因子的评估显示,与仅用LPS处理的对照巨噬细胞相比,GW4869处理的巨噬细胞在LPS攻击后的上清液中TNF-α、IL-1β和IL-6的水平分别显著降低了16.4%、62%和15.6%(图3C-E)。总的来说,这些数据表明,GW4869抑制了RAW264.7巨噬细胞中内毒素引发的外泌体的产生,随后减少了促炎细胞因子的产生。 |
| 体内研究 (In Vivo) |
在小鼠中,GW4869(2.5 μg/g,腹腔注射)可抑制外泌体释放,从而防止 LPS 刺激时促炎细胞因子的产生和心脏炎症。 GW4869 可提高小鼠的存活率并减轻 LPS 引起的心肌功能障碍 [2]。在 CLP 小鼠中,GW4869(2.5 μg/g,腹腔注射)可抑制促炎细胞因子的产生和心脏炎症 [2]。
抑制外泌体释放可阻断LPS刺激的小鼠促炎细胞因子产生和心脏炎症[2] 为了确定GW4869的体内作用,将WT小鼠腹腔注射PBS或GW4869(2.5μg/g)1小时,然后以25μg/g的剂量注射LPS。12小时后,评估血清外泌体和促炎细胞因子的水平以及心肌炎症。我们注意到,在基础条件下,与对照组小鼠的水平相比,GW4869治疗显著降低了血清中外泌体水平37%(图4A)。注射LPS后12小时,与PBS对照组相比,循环外泌体的水平显著升高,AChE活性升高了1.7倍(图4A)。然而,与PBS+LPS组相比,在用GW4869预处理的小鼠中,这种LPS诱导的血清外泌体升高受到了显著抑制(图4A)。因此,与PBS+LPS组相比,GW4869预处理导致血清中内毒素引发的促炎细胞因子(TNF-α、IL-1β和IL-6)的产生显著减少,TNF-α减少17%(图4B),IL-1β减少11%(图4C),IL-6减少28%(图4D)。此外,我们观察到,与用PBS预处理的小鼠相比,用GW4869预处理的老鼠在LPS攻击后心脏中的MPO活性显著降低了12%。这表明GW4869抑制了LPS引起的中性粒细胞向心肌的浸润(图4E)。综上所述,我们的结果表明,用GW4869预处理WT小鼠可以减弱LPS引发的血液中外泌体和促炎细胞因子的产生,从而减轻心肌炎症。 GW4869减轻LPS引起的心肌功能障碍,提高小鼠的存活率[2] 众所周知,循环促炎细胞因子的产生在感染性休克期间介导了心肌功能障碍。鉴于GW4869对促炎细胞因子和心脏炎症的抑制作用,我们接下来评估了GW4869>对内毒素诱导的心脏功能障碍的影响。WT小鼠用PBS或GW4869(2.5μg/g)处理1小时,然后以25μg/g的剂量注射LPS。通过超声心动图评估心功能。与之前的观察结果一致,与对照组相比,我们的内毒素血症小鼠的心脏功能受到抑制(图5A-C)。然而,与用PBS对照预处理的LPS注射小鼠相比,用GW4869预处理小鼠可改善心脏功能,左心室射血分数(EF%)和缩短分数(FS%)显著增加(图5A-C和补充表1)。注射LPS后36小时,用PBS预处理的小鼠(n=12)中只有16.7%存活,而用GW4869预处理的老鼠(n=9)中有66.7%存活(图5D)。总的来说,我们的数据表明,GW4869阻断外泌体的产生可以减少内毒素引起的心肌功能障碍,降低小鼠的死亡率。 GW4869阻断CLP小鼠促炎细胞因子和心脏炎症的产生[2] 接下来,我们研究了GW4869介导的保护作用是否可以在盲肠结扎和穿刺(CLP)诱导的临床相关败血症模型中复制。WT小鼠注射PBS或GW4869(2.5μg/g),然后进行CLP或假手术。在手术后12小时测定血清中外泌体和促炎细胞因子的水平以及心肌炎症。在假手术对照中,与注射PBS的小鼠相比,用GW4869预处理使外泌体浓度降低了33%(图6A)。与内毒素挑战类似,CLP手术导致血清外泌体水平显著升高,如AChE活性所示(图6A)。重要的是,与用PBS预处理的CLP小鼠相比,用GW4869预处理CLP小鼠显著抑制了CLP刺激的外泌体释放(图6A)。血清中促炎细胞因子分析的结果显示,与PBS+CLP组相比,用GW4869预处理的CLP小鼠的TNF-α水平显著降低了85%(图6B),IL-6水平降低了46%(图6C)。与PBS+CLP样品相比,GW4869+CLP组通过MPO活性评估的CLP诱导的心脏炎症大大减轻(图6D)。因此,我们的数据表明,GW4869可以抑制CLP引发的血清和心肌炎症中促炎细胞因子的产生。 |
| 酶活实验 |
GW4869对酶抑制的特异性[1]
将部分纯化的大鼠脑N-Mase和lyso-PAF PLC在不存在或存在GW4869和PS(100μm)的情况下孵育,并如前所述测定SM水解。在蜡样芽孢杆菌N-Mase的情况下,PS不包含在反应混合物中,因为它不影响细菌的酶活性。蜡样芽孢杆菌磷脂酰胆碱PLC在含有100 mm Tris、pH 7.2、25%甘油、20 mm对硝基苯基/磷酰胆碱的反应混合物中在有或没有GW4869的情况下孵育,并在410 nm下用分光光度法定量对硝基苯酚的产生。在GW4869存在或不存在的情况下,将牛肾蛋白磷酸酶2A在含有50 mm Tris、pH 7.4、1 mm二硫苏糖醇、100μm MnCl2和20%甘油的缓冲液中孵育,并按照Jones和Hannun的描述测量磷酸酶活性。在所有试验中,使用10μm GW4869,在添加底物之前用酶预孵育30分钟。 外显子结合试验[3] 根据制造商的规范,用4μM的荧光亲脂性膜染料PKH26或PKH67标记对照或SYTO RNA标记的HSC或含有Cy3-miR-199a-5p的外泌体1小时。将外泌体(0-4μg/ml)或游离Cy3标记的miR-199a-5p(1μM)加入原代小鼠HSC或肝细胞中长达48小时,然后在PBS中洗涤,使用共聚焦显微镜成像或在裂解缓冲液中裂解,并使用Spectra Max®M2微孔板读数器在590/540 nm下测量,以评估PKH26荧光水平。在一些实验中添加外泌体之前,HSC用PKH67染色,肝细胞用远红色染色。在一些结合实验中,HSC用0-100μg/ml RGD或RGE三肽、0-100μM EDTA 0-10μM氯酸钠、0-10μM硫酸钠、0-10ug/ml兔抗小鼠整合素αvβ3 IgG或0-20ug/ml大鼠抗小鼠整合素β5β1 IgG或0-10ug/ml大鼠抗鼠整合素αM(CD11b)进行预处理或共孵育。对于抗体研究,使用非免疫IgG作为阴性对照。 |
| 细胞实验 |
细胞活力测定[1]
细胞类型: MCF7 人乳腺癌细胞。 测试浓度:10-20 μM。 孵育时间:30 分钟(然后用 TNF (3 nM) 处理)。 实验结果: 显着抑制 TNF 诱导的 SM 水解,而 20 μM 的化合物可完全防止 SM 损失。 细胞活力测定[2] 细胞类型:新鲜 RAW264.7 巨噬细胞。 测试浓度:10 或 20 μM。 孵育时间:2小时(然后用1 μg/mL LPS孵育)。 实验结果:用 10 μM GW4869 预处理巨噬细胞后,LPS 触发的外泌体生成在巨噬细胞中显着减弱,AChE 活性降低 22% 即可证明。通过20μM剂量的处理进一步增强了这种衰减。 细胞培养和GW4869治疗[1] MCF7人乳腺癌症细胞在含有10%FBS的RPMI 1640中在37°C和5%CO2中常规培养。除非另有说明,否则在处理时,细胞以1.7×106个细胞/10cm培养皿接种在10ml完全培养基中;24小时后,用7ml RPMI 1640代替培养基,RPMI 1640含有2%FBS和25mm Hepes,pH 7.5,细胞在处理前静置2小时。GW4869通常作为1.5 mm的Me2SO储备悬浮液储存在-80°C下。在使用前,通过添加5%的甲磺酸(MSA)使悬浮液溶解(将2.5μl的5%MSA在无菌双蒸馏水中加入到50μl的GW4869储备悬浮液中;因此,实验时GW4869储液的浓度为1.43 mm)。将悬浮液混合并在37°C下加热至澄清。在用TNF处理之前,细胞与抑制剂预孵育30分钟。对照细胞用含有5%MSA的Me2SO处理,类似于接受GW4869溶液的样品。当测试不同剂量的GW4869时,加入一定量的赋形剂溶液,以等于最高剂量使用的GW48六十九的体积。 鞘磷脂测量[1] 将细胞以0.1×106个细胞/10cm培养皿接种在8ml完全生长培养基中。48小时后,用[甲基-3H]氯化胆碱标记细胞(终浓度为1μCi/ml,溶于10ml生长培养基/平板中)。约60小时后,用10毫升完全培养基追踪细胞90分钟。然后用5毫升PBS洗涤细胞一次,加入7毫升含有2%FBS和25毫米Hepes的培养基,pH 7.5。将细胞静置约1小时后,开始用GW4869预孵育30分钟,然后进行TNF治疗。在适当的时间点,收集每个板的培养基,用2 ml冰冷的PBS洗涤细胞一次。在2 ml PBS的冰上刮取细胞,用另外2 ml PBS洗涤每个板。将细胞和洗涤液与培养基混合,在2000×g(4°C)下离心5分钟。细胞颗粒储存在-80°C下。在测量当天,通过涡旋和超声波处理将颗粒重新悬浮在600μl双蒸馏H2O中。如Andrieu等人所述,细胞裂解物的等分试样用于蛋白质测定,250μl重复用于SM测定。 de Novo生物合成产生的神经酰胺的测量[1] 细胞以1.7×106个细胞/板的速度接种在完全生长培养基中。24小时后,用6ml RPMI 1640代替培养基,RPMI 1640含有2%FBS和25mm Hepes,pH 7.5。在加入GW4869之前,将[3H]棕榈酸酯加入1ml相同培养基中的细胞中,使最终活性达到1μCi/ml。用TNF处理约21小时后,收集培养基,用PBS洗涤培养板一次,PBS与培养基混合,在4°C下以2000×g离心5分钟,收集漂浮细胞。用甲醇从板上刮下细胞,并将其与漂浮物混合。脂质采用Bligh和Dyer法提取。通过薄层色谱法(氯仿、甲醇、4.2 n氢氧化铵;4:1:0.1;v/v/v)分离脂质,将1 ml有机相用于神经酰胺测定,并将0.35 ml重复用于测定无机磷酸盐,以使神经酰胺值标准化。通过与真实标准品进行比较来鉴定神经酰胺带,并在闪烁计数器中定量放射性。 MTT法[1] 将5×103个细胞/孔接种在75μl含有2%FBS和25 mmHepes的RPMI(pH 7.5)的96孔板中。24小时后,首先在15μl培养基/孔中加入GW4869并孵育30分钟,然后在10μl/孔中加入TNF(总体积为100μl/孔)。在指定的时间点,向每个孔中加入25μl MTT储备溶液(PBS中的5mg/ml),并在37°C下在5%CO2中孵育3小时。随后,通过向每个孔加入100μl裂解缓冲液(20%SDS(w/v)、50%N,N-二甲基甲酰胺(v/v)、0.8%乙酸(v/v,pH 4.6-4.8)来溶解细胞。通过用多孔板读数器测量595nm处的OD来定量甲赞染料的产生。我们注意到,与在10cm培养皿中进行的实验(所有其他实验)相比,在96孔板中进行的TNF诱导形态变化的功效(与MTT一样)明显较慢。 用外泌体或GW4869[2] 治疗巨噬细胞 将新鲜的RAW264.7巨噬细胞以1.2×106个细胞/皿的速度放置在100 mm培养皿中,并用含有20μg分离自非LPS处理的巨噬细胞的外泌体(非LPS外泌体)或20μg提取自LPS处理的吞噬细胞的外泌物(LPS外泌物)的培养基或无外泌体的培养基进行处理。在10分钟和24小时收集培养上清液进行细胞因子ELISA测定。为了抑制外泌体的产生,巨噬细胞在用1μg/ml LPS孵育处理前,用含有10μM或20μM GW4869的培养基预处理2小时。24小时后收集培养上清液用于AChE活性测定和细胞因子测定。GW4869最初溶解在DMSO中,形成5 mM GW4869的储备溶液,然后在培养上清液中稀释,在细胞培养条件下达到10μM或20μM GW4869浓度(注:最终DMSO浓度为0.005%)。为了确定DMSO或GW4869的可能毒性,将新鲜的RAW 264.7巨噬细胞(1.2×106个细胞/皿)在含有0.005%DMSO、10μM GW4869和20μM GW4879的培养基中孵育24小时。根据制造商的方案,使用LDH检测试剂盒测量乳糖酶脱氢酶(LDH)释放到培养基中,从而确定细胞损伤。 HSC共培养系统[3] 2孔微培养系统的一个孔接受了用100nM前mir-214转染的外泌体供体P6-HSC。一些细胞用10μM的GW4869培养,GW4869是一种中性鞘磷脂酶2的抑制剂,是外泌体生物合成所必需的。12小时后,将另一个孔接种用亲本miR Selection Fire Ctx慢载体或含有缺乏miR-214结合位点的野生型或突变型CCN2 3'-UTR的相同载体转染的P6 HSC。12小时后,细胞之间的直接通信开始并持续24小时。在某些实验中,培养基中含有100μg/ml硫酸肝素或100μg/ml硫酸盐软骨素。使用双荧光素酶报告物测定系统测量荧光素酶活性,一式三份。将mir-21前转染细胞中的萤火虫荧光素酶活性与未转染细胞中进行比较,并使用肾肾荧光素酶的活性进行标准化。 |
| 动物实验 |
Animal/Disease Models: 10-12 weeks old Male wild-type C57BL/6 mice (Endotoxin-Challenged Mice)[2].
Doses: 2.5 μg/g. Route of Administration: IP once (1 h later, followed by an ip injection of LPS ( 2.5 μg/g, 100 μL)). Experimental Results: Dramatically diminished exosome levels by 37% in sera, compared to levels collected from control mice. At 12 h after LPS injection, the levels of circulating exosomes were increased Dramatically compared to PBS-controls , as evidenced by a 1.7-fold elevation in the AChE activity. Animal/Disease Models: 10-12 weeks old Male wild-type C57BL/6 mice (CLP Polymicrobial Sepsis Model)[2]. Doses: 2.5 μg/g. Route of Administration: IP once (before sham or CLP surgery). Experimental Results: diminished exosome concentration by 33% compared to mice injected with PBS in sham-surgery controls. CLP-stimulated exosome release was Dramatically inhibited by pre-treatment of CLP mice compared to CLP mice pre- treated with PBS. GW4869 Treatment in Endotoxin-Challenged Mice [2] Wild-type male C57BL/6 mice were studied at 10 to 12 weeks old. The mice were randomly assigned to four groups: PBS, GW4869, PBS+LPS and GW4869+LPS (n=5 per group). GW4869, dissolved in DMSO (0.005%), was intraperitoneally (i.p.) injected at one dose of 2.5μg/g. Mice in the PBS+LPS group were pre-injected i.p. with PBS 1 h prior to an i.p. injection of LPS (25 μg/g). Mice in the group of GW4869+LPS were pre-injected i.p. with GW4869 (2.5μg/g) for 1 h, followed by an i.p. injection of LPS (25 μg/g, 100μl). Mice received injections of PBS to a comparable volume (100μl) as controls. The survival rate of the PBS+LPS and GW4869+LPS groups were monitored every 6 h for a 36 h period. Pre-Treatment with GW4869 in CLP Polymicrobial Sepsis Model [2] Polymicrobial sepsis was surgically induced by cecal ligation and puncture (CLP) as previously described. Wild-type C57BL/6 mice (10–12 week, male) were randomly assigned to four groups: PBS+Sham, GW4869+Sham, PBS+CLP and GW4869+CLP. Before sham or CLP surgery, mice were administered by intraperitoneal (i.p.) injection at one dose of GW4869 (2.5μg/g). Same volume of PBS was injected as controls. For CLP surgery, mice were anesthetized by isoflurane inhalation and ventilated with room air using a rodent ventilator. A 1- to 2-cm midline incision was made below the diaphragm to expose the cecum. The cecum was ligated at 1.0 cm from the tip with a 5-0 sterile silk suture. A single through and through puncture was made at the middle between the ligation and the tip of the cecum with an 18-gauge to induce severe septic injury. After puncturing, the cecum was gently squeezed to extrude a small amount of feces and returned to the abdominal cavity. The abdominal wall incision was closed in layers. After surgery, pre-warmed normal saline (0.05–0.1 ml/g body weight) was administered subcutaneously. Post-operative pain control was managed with subcutaneous injection of bupivacain and buprenorphine. Sham controls were exposed to the same surgery; however, their cecum was neither ligated nor punctured. The survival rate of the PBS+CLP and the GW4869+CLP groups was monitored every 6h for 2 days. |
| 参考文献 |
|
| 其他信息 |
Sepsis is an infection-induced severe inflammatory disorder that leads to multiple organ failure. Amongst organs affected, myocardial depression is believed to be a major contributor to septic death. While it has been identified that large amounts of circulating pro-inflammatory cytokines are culprit for triggering cardiac dysfunction in sepsis, the underlying mechanisms remain obscure. Additionally, recent studies have shown that exosomes released from bacteria-infected macrophages are pro-inflammatory. Hence, we examined in this study whether blocking the generation of exosomes would be protective against sepsis-induced inflammatory response and cardiac dysfunction. To this end, we pre-treated RAW264.7 macrophages with GW4869, an inhibitor of exosome biogenesis/release, followed by endotoxin (LPS) challenge. In vivo, we injected wild-type (WT) mice with GW4869 for 1h prior to endotoxin treatment or cecal ligation/puncture (CLP) surgery. We observed that pre-treatment with GW4869 significantly impaired release of both exosomes and pro-inflammatory cytokines (TNF-α, IL-1β, IL-6) in RAW264.7 macrophages. At 12h after LPS treatment or CLP surgery, WT mice pre-treated with GW4869 displayed lower amounts of exosomes and pro-inflammatory cytokines in the serum than control PBS-injected mice. Accordingly, GW4869 treatment diminished the sepsis-induced cardiac inflammation, attenuated myocardial depression and prolonged survival. Together, our findings indicate that blockade of exosome generation in sepsis dampens the sepsis-triggered inflammatory response and thereby, improves cardiac function and survival. [2]
Exosomes mediate intercellular microRNA delivery between hepatic stellate cells (HSC), the principal fibrosis-producing cells in the liver. The purpose of this study was to identify receptors on HSC for HSC-derived exosomes, which bind to HSC rather than to hepatocytes. Our findings indicate that exosome binding to HSC is blocked by treating HSC with RGD, EDTA, integrin αv or β1 siRNAs, integrin αvβ3 or α5β1 neutralizing antibodies, heparin, or sodium chlorate. Furthermore, exosome cargo delivery and exosome-regulated functions in HSC, including expression of fibrosis- or activation-associated genes and/or miR-214 target gene regulation, are dependent on cellular integrin αvβ3, integrin α5β1, or heparan sulfate proteolgycans (HSPG). Thus, integrins and HSPG mediate the binding of HSC-derived exosomes to HSC as well as the delivery and intracellular action of the exosomal payload. [3] |
| 分子式 |
C30H28N6O2.2HCL.XH2O
|
|
|---|---|---|
| 分子量 |
577.5
|
|
| 精确质量 |
576.18
|
|
| 元素分析 |
C, 62.39; H, 5.24; Cl, 12.28; N, 14.55; O, 5.54
|
|
| CAS号 |
6823-69-4
|
|
| 相关CAS号 |
GW4869-13C4; 475570-61-7
|
|
| PubChem CID |
16078967
|
|
| 外观&性状 |
Light yellow to yellow solid powder
|
|
| LogP |
4.577
|
|
| tPSA |
127.21
|
|
| 氢键供体(HBD)数目 |
6
|
|
| 氢键受体(HBA)数目 |
4
|
|
| 可旋转键数目(RBC) |
8
|
|
| 重原子数目 |
40
|
|
| 分子复杂度/Complexity |
856
|
|
| 定义原子立体中心数目 |
0
|
|
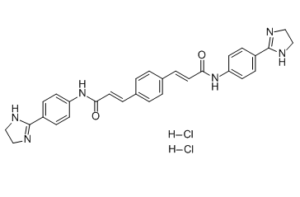
| SMILES |
O=C(NC1=CC=C(C2=NCCN2)C=C1)/C=C/C3=CC=C(/C=C/C(NC4=CC=C(C5=NCCN5)C=C4)=O)C=C3.[H]Cl.[H]Cl
|
|
| InChi Key |
NSFKAZDTKIKLKT-CLEIDKRQSA-N
|
|
| InChi Code |
InChI=1S/C30H28N6O2.2ClH/c37-27(35-25-11-7-23(8-12-25)29-31-17-18-32-29)15-5-21-1-2-22(4-3-21)6-16-28(38)36-26-13-9-24(10-14-26)30-33-19-20-34-30;;/h1-16H,17-20H2,(H,31,32)(H,33,34)(H,35,37)(H,36,38);2*1H/b15-5+,16-6+;;
|
|
| 化学名 |
(E)-3-[4-[(E)-3-[4-(4,5-dihydro-1H-imidazol-2-yl)anilino]-3-oxoprop-1-enyl]phenyl]-N-[4-(4,5-dihydro-1H-imidazol-2-yl)phenyl]prop-2-enamide;dihydrochloride
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中,避免吸湿/受潮。 |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.7316 mL | 8.6580 mL | 17.3160 mL | |
| 5 mM | 0.3463 mL | 1.7316 mL | 3.4632 mL | |
| 10 mM | 0.1732 mL | 0.8658 mL | 1.7316 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|---|
|
 |